前立腺癌の第一次処理後における特異的マーカーであるPSAのカットオフ値以上で生化学的再発とされ、セカンドラインとしての放射線或いは内分泌治療が開始される。が、見えない癌に対し、これらの治療は患者にとって有益であろうか?その後必発するであろう再燃でエンドラインとして抗がん剤等での治療もまた同様に、な患者にとり有意ある対応であろうか・・・?。私は甚だ疑問だと思う。
近年iPS細胞、ES細胞等の還元論的医概念では癌幹細胞(前駆細胞)説(仮説)が優位で、一部臨床的にも同定されている。従前のがん治療で奏功が認められているのは癌娘細胞だけとし、転移、増殖、浸潤能があるとされている肝心の癌幹細胞(癌母細胞)及び未分化の癌細胞は治療により逆に、癌は増殖増進していた事が報告されている。
内分泌治療(アンドロゲン枯渇或いは、アナログ)や放射線での癌の退縮は高奏功を観察できる。但し、上皮組織内にある腺細胞にある癌だけで、がん幹細胞は細胞死していない。逆にがん幹細胞の分裂へのヘルパーの役割(ラス増殖因子)を担ったトリガシグナルとなり癌幹細胞の分裂増殖を促進させ、且つ悪性度も増加させている。このことは以前に述べたWnt-5aやNestinの関与する一因子と深く想定される。
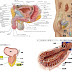
前立腺がんの多数は腺癌とされ(90%)、分泌細胞由来ではあるが、基底細胞由来も確認されている。この事実は未分化細胞の時点で既に癌化(DNAエラー)されており、分化後のG0期サイクリン休止(static)では細胞の分裂は不可能であるが、放射線照射などで娘癌細胞も可塑的に癌幹細胞に還元する可能性は否定できない。否定すればIPS理論は成立しないからである。
NOTES
1) 現時点での、癌幹細胞(前駆細胞)のプロモータとしては『PSCA (Prostate Stem Cell Antigen) 』,レポーター分子としては『GFP (Green Fluorescence Protein) 』が有力視されています。低分化癌GS8以上などの悪性腫瘍のマーカーとして期待できそうです。
2)乳がん 脳腫瘍 大腸がん 前立腺がん 膵臓癌 骨髄性白血病 等が同定、若しくは癌幹細胞の存在が認識されています。
3)がん細胞全てに浸潤や転移能は無く、単離したがん細胞が他臓器に接着することなどは困難と云われています。あるとすれば癌幹細胞です。もしくは、骨に転移したとするならば、骨の未分化細胞が前立腺由来のがん細胞に化けたかである(これは空想的発想です)。
4) 一旦成熟した細胞は多分化能を持つ幹細胞に戻る事も、分裂することも不可能とされてきたが 癌幹細胞は自己複製(コピー)も娘細胞も非対称に増殖させる事が可能とされている。またiPSも分化した細胞から3胚葉(外胚葉、中胚葉、内胚葉)の多分化可能な幹細胞を作成することが可能とされています。
5)前立腺幹細胞からの最終分化の前工程で中間細胞期があり、アンドロゲンの作用を受けて育った細胞が腺細胞と分化しします。
従ってホルモン治療で癌の退縮は腺細胞となりますが、幹細胞や神経分泌細胞は退縮しません。
腺細胞の細胞サイクリンに比べ基底細胞の細胞分裂は遅く、放射線や抗がん剤の効果が低い原因と言われています。
参考サイト
『前立腺癌の増殖亢進を引き起こすwnt-5a』問題について
加藤茂明グループ等による不正論文(捏造)疑惑がありますが、当論文の適否は決着していません。(2012/3追記)
『MAB(ホルモン療法)で前立腺癌の転移を誘発促進させるネスチン』について
前立腺癌における神経内分泌細胞の発現とその臨床的意義(京都府立医大)
進行前立腺通常型腺癌における神経内分泌腫瘍細胞の存在はホルモン療法にお
ける再燃の危険因子と考えられた。
抗がん剤で耐剤性 癌増殖 Nature Medicine から (2012/8/17)
skip to main |
skip to sidebar
僕は、人様から非難される程に女好きやない。 そら、ちょっとは好きやけど・・・調べてみたら 過度の淫行が原因なんて書いてある。ホンマかいな。
ページビューの合計
監修文責・ 図提供 岡村常実
Translate
このブログを検索
人気の投稿
-
≪ TNM 分類( UICC )の番外転移:腹膜播種、直腸転移、吻合膀胱頸口≫ TNM 分類に無い疑転移で、 PSA 再発を来たしたサルベージでは放射線の局処床(prostatic bed)照射で約半数に顕著な臨床的効果を認め、各機関で実施しているスタディに於いても5年 ...
-
PSA にビビリながら射精してるのは日本人だけではない様だ。 2013 年の或るスタディで、 50 歳以下の男性 35 人と PSA スクリーニング対象である 50 歳以上の男性 (j1) 25 人に射精をさせて、射精前と、射精後1時間...
-
前立腺(Prostate)とPSA(Prostate specific antigen)と癌(Cancer) 《前立腺概要》 人では骨盤内膀胱下に位置したクルミ大の外分泌器官(内胚葉由来の実質臓器)で、成人では精液の一部である PSA を外分泌する。形成及び退縮は男...
-
RRP1次処理後におけるPSA再発は約30%ほどであり、その殆どは術後1ヶ年以内である事が、各施設で報告されている。では術後15年ではこの数字はどのように変化するのであろうか。そして、そこでは再発率30%は幻想にしか過ぎないことが理解できる。 日泌会・厚生科学研究班編/医療・...
-
『PSA難民・・・』ではLH(黄体ホルモン)、ED治療薬(PDE_5阻害薬)について触れましたが、今回補足を述べます。 バイアグラ・シアリス・レビトラなどのED治療薬はPDE_5の活性化(勃起した状態を元の自然な状態に復旧させる働き)を阻害する薬(サプレッサー)です。勃起...
-
リンパ行性と血行転移 何故骨転移か? TNM 分類では血行性転移とリンパ行性転移の二分類とされ、リンパ行性からは膀胱に、或いは仙骨への転移が希に観察される。が、これらは直接侵蝕或いは逆流による転移であり、肺への転移もリンパ行性と云われているが血行...
-
前回超音波では癌らしき物はいなかったのですが、PSA値が高い【 60歳以上ではPSA=3.0以上 65歳以上では3.5以上 70歳以上でPSA=4.0以上で癌容疑の説もあります】ので生検(バイオプシー】をする事になりました。泌尿器科の部長ではありましたが 医師の権力とは偉いもの...
-
ヒトの細胞性免疫にはウイルスやクリプトコッカスなど細胞内寄生感染に応答する細胞性免疫系とダニや細胞外繁殖に応答する 液性免疫が知られている。免疫前駆 T 細胞(ナイーブ TH0 )はマクロファージ等の抗原提示細胞のサイトカインにより、ウイルスならば TH 1( T...
-
Women have prostate gland tissue as men, although the amount seems to vary markedly between individuals. In women who ejaculate, the pro...
-
前回の核酸製剤(十数の DNA,RNA 核酸断片)は世界の多くで創薬途上にあり、一方、ウイルス治療では HF-10= 三重大学、 G47 Δ =東京大学、アドベキシン=千葉大学、 Reolysin= パトリック・李(カルガリー大学)、 2012 年には実用化の予定とされてい...
僕のおすすめ
がん死亡のプロセスとチャート(直接死因とその発生):
http://ina-takasi.blogspot.jp/2014/07/blog-post_31.html
消化器がんと血液がん、その他固形癌で死亡機序が異なるのは何故?
http://ina-takasi.blogspot.jp/2014/07/blog-post_31.html
消化器がんと血液がん、その他固形癌で死亡機序が異なるのは何故?